界定管理类别 明确审评依据(填充醫療器械無源)
□ 张旭 刘文博 赵鹏
近年来,在消费升级和“颜值”营销的影响下,消费者对医疗美容的接受程度逐渐提升。按照卫生行政管理有关规定,医疗美容是指运用手术、药物、医疗器械以及其他具有创伤性或者侵入性的医学技术方法对人的容貌和人体各部位形态进行的修复与再塑。医疗美容过程中往往会使用医疗器械,与其他医疗器械相比,可用于医疗美容的医疗器械的核心功能是为患者整形及美容,其作用效果主要通过物理等方式获得,不通过药理学、免疫学或者代谢方式获得,或者虽有这些方式参与其中但只起辅助作用。
医美常用无源医疗器械材料分类
按照医疗手段,医疗美容可分为手术类项目和非手术类项目。
手术类项目旨在从根本上改变或改善眼、鼻、胸等身体部位的外观。非手术类项目(又称轻医美)包括注射项目、皮肤项目及其他项目。非手术类项目因创伤小、恢复快、风险低而广受关注。
具体来说,医疗美容过程中常用的非手术类(假体类填充物)无源医疗器械包括:面部整形填充物,材料多采用膨体聚四氟乙烯、硅橡胶;乳房植入体,材料多采用固体硅胶、硅凝胶;面部埋植线,材料多采用聚对二氧环己酮。非手术类(注射类填充物)无源医疗器械包括交联透明质酸钠(玻尿酸)、非交联透明质酸钠、天然或重组胶原蛋白、含可吸收聚酯微球的凝胶材料、含不可吸收微球的凝胶材料等。
整形用注射类医疗器械介绍
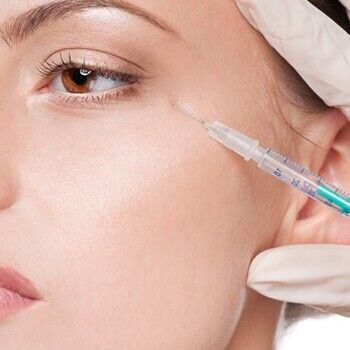
根据2017年版《医疗器械分类目录》,整形用注射类产品的分类编码为13无源植入器械-09整形及普通外科植入物-02整形用注射填充物,按照第三类医疗器械管理。与可用于医疗美容的假体填充物类医疗器械相比,注射类医疗器械的美容效果保持时间较短,往往需持续、多次注射才能保持长期效果。但由于具有易操作、创伤小、恢复时间短等特点,注射类医疗器械在我国医疗美容领域的应用越来越多,其市场规模占可用于医疗美容医疗器械的比重不断增加。
常见的整形用注射类产品有注射用交联透明质酸钠凝胶、注射用透明质酸钠凝胶、胶原蛋白植入剂、注射用聚左旋乳酸填充剂、注射用透明质酸钠溶液等。
透明质酸钠类填充剂(玻尿酸) 透明质酸钠类填充剂(玻尿酸)在医疗美容注射领域广泛应用于除皱、填补凹陷等方面。透明质酸钠类面部注射填充材料在产品注册申请及技术审评过程中,宜参考《透明质酸钠类面部注射填充材料临床试验指导原则》《透明质酸钠类面部注射填充材料注册技术审查指导原则》以及YY/T 0308《医用透明质酸钠凝胶》、YY/T 0962《整形手术用交联透明质酸钠凝胶》。
由于透明质酸钠具有良好的亲水性,有企业将其与一些“营养成分”搭配,混合形成以透明质酸钠为主要成分的溶液,俗称“水光针”。“水光针”用于注射到真皮层,主要通过所含透明质酸钠等材料的保湿、补水等作用,改善皮肤状态。根据国家药监局今年3月印发的《关于调整〈医疗器械分类目录〉部分内容的公告》,“水光针”产品已被纳入第三类医疗器械管理。
聚酯类微球填充剂 聚酯类微球填充剂是以聚左旋乳酸微球(PLLA)或聚己内酯(PCL)微球为主要成分的注射用医疗器械。此类产品适用于注射到真皮深层,纠正中重度鼻唇沟皱纹,在市场上被称为“童颜针”“少女针”。相比透明质酸钠,可吸收聚酯类材料的吸收时间一般更长,美容效果的维持时间因此相对较久。
聚酯类微球填充剂在产品注册申请及技术审评过程中,宜参考YY/T 0510《外科植入物用无定形聚丙交酯树脂和丙交酯-乙交酯共聚树脂》、YY/T 0661《外科植入物用聚(L-乳酸)树脂的标准规范》、YY/T 1806.1《生物医用材料体外降解性能评价方法 第1部分:可降解聚酯类》。
胶原蛋白类产品 胶原蛋白是人体组织器官的主要结构蛋白,胶原蛋白及重组胶原蛋白材料在临床上广泛用于人体皮肤、口腔等组织的修复。在医疗美容行业,胶原蛋白被作为组织填充剂注射至面部组织内,起支撑填充作用,以达到去除皱纹、填充修复皮肤凹陷目的。由于其材料特性,未经交联等工艺处理的胶原蛋白填充剂的效果维持时间较短。目前,已有如动物源胶原蛋白植入剂、重组Ⅲ型人源化胶原蛋白冻干纤维等产品获批上市。
注射型胶原蛋白植入剂在产品注册申请及技术审评过程中,宜参考YY 0954《无源外科植入物 Ⅰ型胶原蛋白植入剂》。
假体填充物产品介绍
为保持较长期的调整效果,医疗美容行业对于面部、胸部等部位的整形多采用手术填充手段,如隆鼻、丰胸等。根据2017年版《医疗器械分类目录》,用于面部或其他部位软组织填充类产品的分类编码为13无源植入器械-09整形及普通外科植入物-01整形填充材料,产品包括硅橡胶外科整形植入物、面部假体、面部整形填充材料、面部整形植入物、硅橡胶皮下软组织植入体等。整形用面部植入假体在产品注册申请及技术审评过程中,宜参考《整形用面部植入假体注册技术审查指导原则》。
用于隆乳和乳房再造填充类产品的分类编码为13无源植入器械-09整形及普通外科植入物-03乳房植入物,产品包括硅凝胶填充乳房植入体等,与面部填充物产品一同按照第三类医疗器械管理。乳房植入体产品在注册申请及技术审评过程中,宜参考《乳房植入体产品注册技术审查指导原则》、YY/T 0647《无源外科植入物 乳房植入物的专用要求》、YY/T 1457《无源外科植入物 硅凝胶填充乳房植入物中寡聚硅氧烷类物质测定方法》。
假体填充物常见材料类型包括膨体聚四氟乙烯(ePTFE)、硅橡胶/硅凝胶等,在医学中已应用多年。
医疗美容行业监管趋严
在医疗美容市场规模持续扩大的同时,行业乱象陆续出现,例如可用于医疗美容的医疗器械质量安全性参差不齐、虚假广告泛滥、部分机构无证经营不足等。
为规范医疗美容行业发展,整治违法违规行为,我国不断加强对医疗美容行业的监管。2019年以来,全国部分地区开展了医疗服务多元化监管试点工作,医疗广告宣传被划出清晰红线。2020年,国家卫生健康委、中央网信办、国家药监局等八部门联合印发《关于进一步加强医疗美容综合监管执法工作的通知》,医疗美容行业的长效监管机制不断完善。
人们对健康、美丽的渴望以及与日俱增的医疗美容需求成为刺激医疗美容行业快速发展的强大动力。随着生物材料科学等医疗器械领域创新技术的发展,未来,可用于医疗美容的医疗器械品种将更加丰富,产品管理属性界定、技术审评、上市后监管等面临挑战。建议监管部门建立科学长效的监管机制,开展监管科学研究,确保群众用械安全。
本文来自【中国医药报】,仅代表作者观点。全国党媒信息公共平台提供信息发布传播服务。
ID:jrtt